Formål
- Sikre at sårbare områder i legemiddelhåndteringen som representerer en risiko blir identifisert, og at det blir satt inn nødvendige tiltak som reduserer risikoen
- Bidra til at legemiddelhåndteringen blir fulgt opp gjennom systematiske samtaler mellom institusjonssjef, kvalitetssjef, avdeingssykepleiere, fagsykepleiere og legemiddelfaglig rådgiver ved institusjonen
- Bidra til at farmasøytiske revisjoner følges opp på en systematisk måte ved bruk av kvalitetssystemet EQS
Omfang/virkeområde
- Rutinen gjelder for alle helsehus og langtidshjem i Sykehjemsetaten
Ansvar
- Institusjonssjef har overordnet systemansvar for legemiddelhåndteringen ved institusjonen
- Institusjonssjef har ansvaret for at legemiddelhåndteringsrutiner implementeres
- Institusjonssjef har ansvar for at det utarbeides risiko- og sårbarhetsanalyser knyttet til legemiddelhåndteringen.
- Institusjonssjef har ansvar for at en legemiddelfaglig rådgiver utpekes ved institusjonen i henhold til rutine Legemiddelfaglig Rådgiver i Sykehjemsetatens institusjoner
Aktivitet/beskrivelse
1. Risiko- og sårbarhetsanalyser
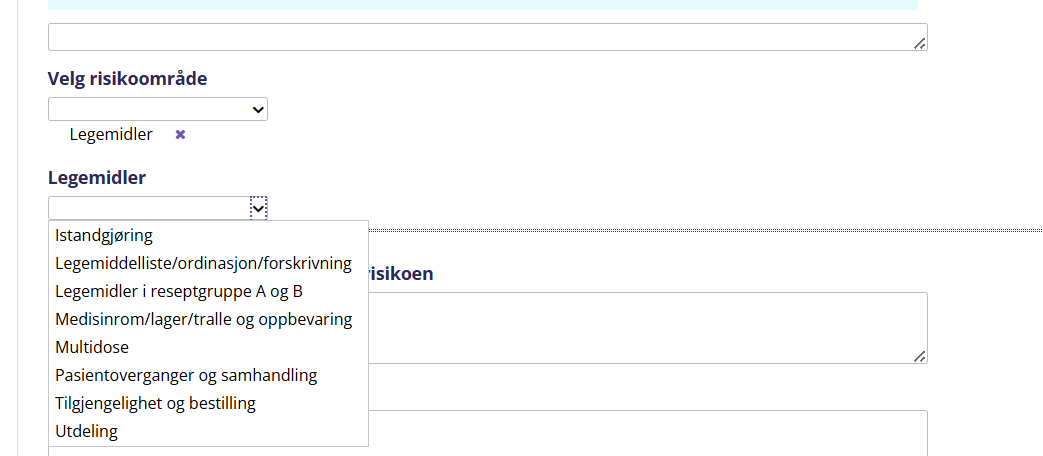
Det skal utarbeides risiko- og sårbarhetsanalyse i EQS knyttet til legemiddelhåndteringen på langtidshjem og helsehus. Se rutine Risikostyring og risiko- og sårbarhetsanalyse i Sykehjemsetaten (Ikke tilgjengelig) som beskriver hvorfor og hvordan man gjennomfører en risiko- og sårbarhetsanalyse (ROS). I ROS-modulen i EQS velges "Legemidler" som er definert som et eget risikoområde og deretter aktuell(e) underkategori(er). Den legen som er utpekt som legemiddelfaglig rådgiver ved institusjonen bør involveres i arbeidet. For å beslutte hvilke delområder som skal inngå i ROS-analysen anbefales det å ta utgangspunkt i legemiddelhåndteringsprosessen, se Legemiddelhåndtering- prosesskart Delområdet "tilberedning av legemidler" skal risikoanalyseres regelmessig og alltid ved endring i arbeidsprosess, se Legemiddelhåndteringsforskriften § 8 . For ytterligere mulige eksempler på delområder med tilhørende risikoområder se dokumentet Mulige risikoområder i legemiddelhåndteringen
2. Møter for oppfølging av legemiddelhåndteringen
Minimum hver 6. måned bør nøkkelpersoner (f. eks institusjonssjef, legemiddelfaglig rådgiver, kvalitetssjef, fagsykepleiere ressurssykepleiere i palliasjon og avdelingssykepleierene) møtes for å snakke om legemiddelhåndtering og oppfølging av denne. Møtet kan arrangeres som et lokalt kvalitets råd (LKR) eller man kan benytte andre etablerte møtearenaer etter hva som er hensiktsmessig for den enkelte institusjon.
Til møtene medbringes relevant dokumentasjon avhengig av møteagendaen: Relevante rutiner, aktuelle skjemaer, ROS-analyse, legemiddelstatistikk, revisjonsrapport, resultater fra internkontroller, rapporter fra kompetansemodulen Dossier, oversikt over uønskede hendelser fra EQS/ relevante visninger i Power BI, og evt. rapporter fra Gerica.
Tema for møtene kan være:
- Nye og reviderte rutiner gjenomgås. Se prosesskart for legemiddelhåndtering i EQS
- Oppfølging etter farmasøytisk revisjon. Hva er status for handlingsplanen?
- Gjennomgang av ROS-analyse og handlingsplan
- Samarbeid med sykehjemslege(r) om ordinasjoner og oppfølging av legemiddelbruk. Herunder tilhører:
- Oppfølging og dokumentasjon av faste- og behovslegemidler . Se rutine Dokumentasjon av legemidlers effekt, bivirkninger og seponeringsreaksjoner i Gerica
- Mål for legemiddelbruk, benytt PowerBI-rapporten Legemiddelbruk
- Legemiddelgjennomgang, se rutine Dokumentet er ikke gyldig (Ikke tilgjengelig) og PowerBI-rapporten LMG og risiko for underernæring - langtidshjem
- Gjennomgang av uønskede hendelser (rapportering, behandling og oppfølging i EQS eller annet kvalitetssystem)
- Opplæring av nyansatte og oppfølging av medarbeideres kompetanse i legemiddelhåndtering
- Fullmakter til utdeling av legemidler
- Medisinromansvarlig sykepleier/vernepleier rapporterer. Se rutine Legemiddellagre - ansvar og internkontroll
- Rutiner for bestilling av legemidler og "basisliste" Se rutine Bestilling, mottak og retur av legemidler.
- Økonomiske hensyn i legemiddelhåndteringen, Se rutine Bestilling, mottak og retur av legemidler, generisk bytte, terapivalg etc.
- Identifiseing av risikoområder og forbedringsområder
- Legemiddelhåndtering kan innebære økt risiko for emosjonelle krav og belastninger, som høyt arbeidspress, frykt for å gjøre feil, bekymring for konsekvenser av feil og andre følelsesmessige utfordringer. Malverket «Emosjonelle krav og belastninger på jobb» i EQS skal brukes for å identifisere risikoområder og bidra til å forebygge, håndtere og redusere slike belastninger. Formålet er også å fremme bevissthet og åpenhet om temaet, og å støtte et arbeidsmiljø der emosjonelle utfordringer tas på alvor.
3. Farmasøytisk revisjon
- Alle SYEs institusjoner skal hvert år ha farmasøytisk revisjon. Revisjonene gjennomføres av farmasøyter fra Apotek 1.
- Tema settes på bakgrunn av uønskede hendelser meldt i EQS, hva farmasøytene og etatsoverlege mener det må settes fokus på for å oppnå forbedring, samt innspill fra revisjonsfarmasøytene i Apotek 1.
Forberedelse
- Apotek 1 sender et revisjonsvarsel to uker i forkant av revisjonen. Skulle oppsatt dato ikke passe, tar institusjonssjef kontakt for å finne et nytt tidspunkt.
- Evt. dokumentasjon og relevante interne rutiner som etterspørres av revisjonsfarmasøyt skal sendes i henhold til frist oppgitt i revisjonsvarselet.
- NB: Dokumenter som innholder personsensitive opplysninger må anonymiseres
- Institusjonssjef må sørge for at personer som skal delta på revisjonen er tilstede for intervju og evt. befaring og at egnede møterom er stilt til disposisjon på revisjonsdagen
Gjennomføring
- Oppstartsmøte – presentasjon av plan for dagen, tema og hva revisjon er
- Intervjuer med aktuelle personer
- Evt. befaring og observasjoner av arbeidsprosesser
- Gjennomgang av aktuell dokumentasjon hvis aktuelt
- Oppsummeringsmøte – gjennomgang av funn. Deltakerne på revisjonen får mulighet til å stille spørsmål og evt. misforståelser kan oppklares.
- Farmasøyt skriver en rapport som sendes institusjonssjef og farmasøytene i SYE innen 2 uker etter revisjonsdagen
Oppfølging ved den enkelte institusjon:
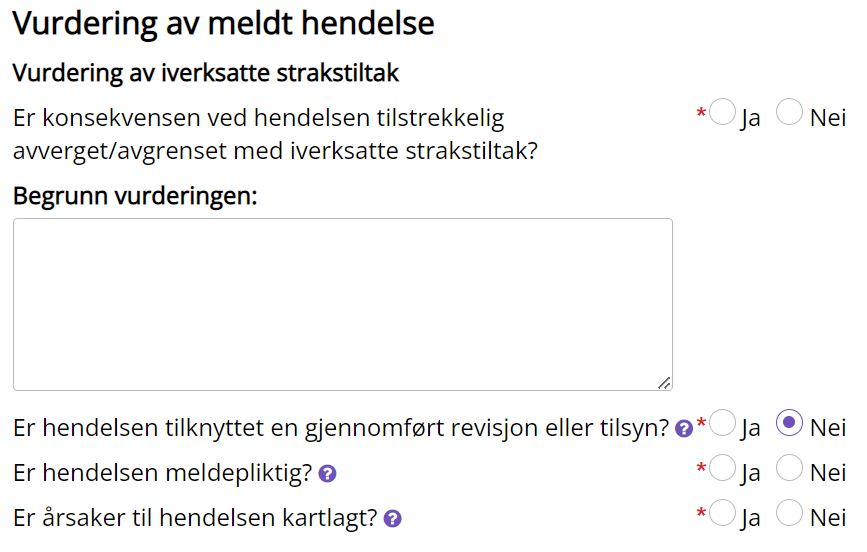
- Institusjonssjef har ansvar for at evt. uønskede hendelser som påpekes i revisjonen meldes og saksbehandles i EQS. Kryss av i "ja-feltet" at hendelsen er tilknyttet en gjennomført revisjon eller tilsyn (se bilde under).
Frist for å ha opprettet tiltak i EQS eller annet kvalitetssystem er 3 uker etter gjennomført revisjon. Effekten av tiltakene som iverksettes skal evalueres. Utarbeidelse av tiltak og hvordan disse skal evalueres skal være en medarbeiderdrevet prosess og legemiddelfaglig rådgiver bør involveres i arbeidet.
- Diskuter mulige årsaker til den uønskede hendelsen. Anbefalt verktøy for å finne årsaken er «5 ganger hvorfor,» se Forbedringsguiden utgitt av Helsedirektoratet. Dersom årsaken ligger på «systemnivå» i SYE eller feil oppdages i sentral rutine, ta kontakt med farmasøytene i SYE.
- Når mulige årsaker er identifisert kan forbedringstiltak/ korrigerende tiltak planlegges og testes ut i liten skala (f. eks på en avdeling, på et fåtall pasienter/beboere etc.). Bruk gjerne PDSA-skjema. Eksempel på et slikt skjema er vedlagt under fanen relatert. Skjemaet kan redigieres etter behov.
- Lag et (eller flere) mål. Målet bør være så konkret og realistisk som mulig, og aller helst målbart. Hvor stor forbedring ønsker vi å oppnå? Innen når? Skal det utføres målinger? Hvem og hvordan skal dette gjøres?
- Evaluer om iverksatte tiltak har hatt effekt. Hvis effekt uteblir/mål ikke nås må korrigering utføres. En evaluering kan av bestå av internkontroller, målinger etc.
- Farmasøytene i SYE adm kan kontaktes for råd under utarbeidelse av tiltak og hvordan disse skal evalueres.
Oppfølging av SYE adm
- Det skal hvert år utarbeides en samlerapport som inneholder en oversikt over alle uønskede hendelser og forbedringsområder som er identifisert av revisjonsfarmasøyt. Denne utarbeides av Apotek 1.
- Rapporten gjennomgås i SYE adm som beslutter hvilke tiltak på systemnivå som skal iverksettes på bakgrunn av rapportens innhold.
4. Internkontroll legemiddelhåndtering - sjekkliste i EQS
- To ganger i året skal institusjonene gjennomføre internkontoll i legemiddelhåndtering. Sjekkliste for internkontroll er utarbeidet i EQS og bør benyttes i sin helhet ved disse to kontrollene. Frist er 1. mai og 1. nov Se sjekkliste Internkontroll Legemiddelhåndtering(SYE) (Ikke tilgjengelig)
- Internkontroll kan også gjennomføres resten av året etter behov. Ved disse kontrollene benyttes de delene av sjekklisten som vurderes som hensiktsmessige, evt. hele sjekklisten.
5. Legemiddelstatistikk
Se PowerBI-rapportene Legemidler fra Apotek 1 og Legemiddelbruk. Bruk rapportene til å identifisere utfordringer og forbedringsområder og for å følge opp at forbedringstiltak har ønsket effekt.
6. Legemiddelgjennomgang
Se rutine Legemiddelgjennomgang og PowerBI-rapporten LMG og risiko for underernæring - langtidshjem
Hjemmel
Forskrift om legemiddelhåndtering i virksomheter som yter helsehjelp
Rundskriv: Legemiddelhåndtering for virksomheter og helsepersonell som yter helsehjelp
Forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten